Kelarutan (s)
Bayangkan jika kita menambahkan satu sendok teh kristal natrium klorida ke dalam segelas air, kemudian diaduk. Kristal itu larut bukan? Apa yang terjadi jika natrium kolrida ditambah dan ditambah lagi? Apakah natrium korida selalau dapat larut? Pada suatu saat larutan akan menjadi jenuh, dan garam tidak dapat larut lebih banyak lagi
Kelarutan (Solubility) adalah jumlah maksimum zt yang dapat larut dalam sejumlah tertentu pelarut.
Kelarutan suatu zat dinyatakan dalam mol L--1
Menentukan Kelarutan
Rancanglah sebuah percobaan untuk menentukan kelarutan garam dapur dalam air. Diskusikan hasil rancanganmu.
CONTOH SOAL
Sebanyak 4.35 gram Ag2CrO4 dapat larut dalam 100 mL air. Nyatakan kelarutan Ag2CrO4 tersebut dalam mol L-1
JAWAB
Mol Ag2CrO4 = 4,35 gram : 332 gram mol-1 = 1,31 x 10-5 mol
Kelarutan = 1,31 x 10-5 mol : 0.1 L = 1,31 x 10-4 mol L-1
Tetapan hasil kali kelarutan (Ksp)
Perak kromat (Ag2CrO4) merupakan contoh garam yang sukar larut. Jika kita memasukkan sedikit saja kristal garam itu ke dalam segelas air kemudian diaduk, maka akan terlihat sebagian besar garam itu tidak larut. Larutan perak kromat mudah sekali jenuh. Apakah setelah mencapai keadaan jenuh proses melarut berhenti?
Ag2CrO4 (s) 2Ag+(aq) + CrO42-(aq)
2Ag+(aq) + CrO42-(aq)
Tetapan kesetimbangan dari garam atau basa yang sedikit larut disebut Tetapan Hasil Kali Kelarutan dan dinyatakan dengan lambang Ksp
persamaan tetapan hasil kali kelarutan untuk Ag2CrO4 adalah
Ksp = [Ag+] 2 [CrO42-]
Secara umum persamaan kesetimbangan larutan garam AxBy
AxBy(s)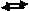 xAy+(aq) + yBx-(aq)
xAy+(aq) + yBx-(aq)
Ksp = [Ay+] x [Bx--]y
Rumus praktis
Ksp = (n-1)n s n







 Sebagai contoh kita ambil CuBr (Tembaga (I) Bromida). Kelarutan CuBr dalam 1 liter adalah 0,0287 gr pada 25 C. Kita timbang CuBr sebanyak 0,0287 gr dan kemudian kita masukan ke dalam 1 L air. *Pada saat awal CuBr di masukan ke dalam air, maka kation Cu+ dan anion Br- belum terbentuk, dan dengan berlangsungnya proses pelarutan maka konsentrasi kedua ion tersebut akan meningkat. Proses disosiasi CuBr menjadi ion-ionnya dapat ditulis sebagai berikut:
Sebagai contoh kita ambil CuBr (Tembaga (I) Bromida). Kelarutan CuBr dalam 1 liter adalah 0,0287 gr pada 25 C. Kita timbang CuBr sebanyak 0,0287 gr dan kemudian kita masukan ke dalam 1 L air. *Pada saat awal CuBr di masukan ke dalam air, maka kation Cu+ dan anion Br- belum terbentuk, dan dengan berlangsungnya proses pelarutan maka konsentrasi kedua ion tersebut akan meningkat. Proses disosiasi CuBr menjadi ion-ionnya dapat ditulis sebagai berikut:
